Orbitales Atómicos
Contents
12. Orbitales Atómicos#
Para la parte angular se tiene la ecuación de valores propios
donde \(\Lambda^2\) es el Legendriano.
Inserto matemático: Legendriano
El Legendriano \(\Lambda^2\) se define por
La solución a la parte angular son los armónicos esféricos \(Y_l^{m_l}(\theta,\phi)\).
Note que \(l\) y \(m_l\) son números cuánticos que deben cumplir:
En la tabla se muestran los primeros armónicos esféricos.
\(l\) |
\(m_l\) |
Armónico esférico \(Y_l^{m_l}(\theta,\phi)\) |
|---|---|---|
0 |
0 |
\(\frac{1}{(4\pi)^{1/2}}\) |
1 |
-1 |
\(+\frac{3}{(8\pi)^{1/2}} \sin \theta e^{-i\phi}\) |
1 |
0 |
\(\frac{3}{(4\pi)^{1/2}} \cos \theta\) |
1 |
1 |
\(-\frac{3}{(8\pi)^{1/2}} \sin \theta e^{i\phi}\) |
2 |
-2 |
\(\frac{15}{(32\pi)^{1/2}} \sin^2 \theta e^{-2i\phi}\) |
2 |
-1 |
\(+\frac{15}{(8\pi)^{1/2}} \sin \theta \cos \theta e^{-i\phi}\) |
2 |
0 |
\(\frac{5}{(16\pi)^{1/2}} (3\cos^2 \theta - 1)\) |
2 |
1 |
\(-\frac{15}{(8\pi)^{1/2}} \sin \theta \cos \theta e^{i\phi}\) |
2 |
2 |
\(\frac{15}{(32\pi)^{1/2}} \sin^2 \theta e^{2i\phi}\) |
Importe las siguientes librerías
numpy
pyplot de matplotlib
special de scipy
# Librerías
#%matplotlib notebook
from scipy import special
import numpy as np
from matplotlib import pyplot as plt
Definimos un mallado que considere \(\theta \in [0,\pi]\) y \(\phi\in[0,2\pi]\)
La idea es pensar en graficar una figura en tres dimensiones
 y que necesitaremos todas las combinaciones de todos los valores de \(\theta\) y \(\phi\)
y que necesitaremos todas las combinaciones de todos los valores de \(\theta\) y \(\phi\)

Aprendizaje de código
Utilice las siguientes instrucciones
theta = np.linspace(0,np.pi,200)
phi = np.linspace(0,2*np.pi,200)
THETA,PHI = np.meshgrid(theta,phi)
# Mallado
theta = np.linspace(0,np.pi,200)
phi = np.linspace(0,2*np.pi,200)
THETA,PHI = np.meshgrid(theta,phi)
Seleccione un valor de \(l\) y \(m_l\)
Note
se recomienda \(l=1\) y \(m_l=1\) para empezar, pero puede probar con otros
# Seleccione l y ml
l = 1
ml = 1
A continuación graficaremos armónicos esféricos y su cuadrado.
Aprendizaje de código
Copie y pegue el siguiente código
R = abs(special.sph_harm(ml,l,PHI,THETA))
R = R**2
X = R * np.sin(THETA) * np.cos(PHI)
Y = R * np.sin(THETA) * np.sin(PHI)
Z = R * np.cos(THETA)
fig = plt.figure()
ax = plt.axes(projection='3d')
ax.plot_surface(X, Y, Z,cmap='cividis')
ax.set_xlim(-R.max(),R.max())
ax.set_ylim(-R.max(),R.max())
ax.set_zlim(-R.max(),R.max())
ax.set_title("$Y^2$"+" l="+str(l)+" ml="+str(ml))
plt.show()
# Gráfica
R = abs(special.sph_harm(ml,l,PHI,THETA))
R = R**2
X = R * np.sin(THETA) * np.cos(PHI)
Y = R * np.sin(THETA) * np.sin(PHI)
Z = R * np.cos(THETA)
fig = plt.figure()
ax = plt.axes(projection='3d')
ax.plot_surface(X, Y, Z,cmap='cividis')
ax.set_xlim(-R.max(),R.max())
ax.set_ylim(-R.max(),R.max())
ax.set_zlim(-R.max(),R.max())
ax.set_title("$Y^2$"+" l="+str(l)+" ml="+str(ml))
plt.show()
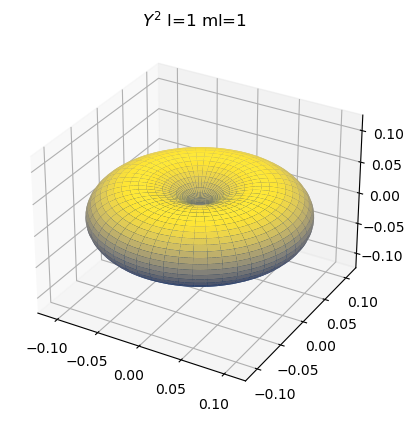
Recordemos que la eigenfunción es el producto de una parte radial y una parte angular \(\psi_{n,l,m_l}=R_{n,l}(r)Y_l^{m_l}(\theta,\phi)\)
Nombraremos a los orbitales p como:
El orbital \(p_z\) es real, pero \(p_-\) y \(p_+\) son complejos. Recordando la fórmula de Euler:
Hacemos la combinación lineal:
Represente la parte angular de las combinaciones lineales de \(p_-\) y \(p_+\) para formar \(p_x\) y \(p_y\).
# px y py
Rz = special.sph_harm(0,1,PHI,THETA)
R_m = special.sph_harm(-1,1,PHI,THETA)
R_p = special.sph_harm(+1,1,PHI,THETA)
R_x = (R_m-R_p)/np.sqrt(2)
R_y = 1j*(R_m+R_p)/np.sqrt(2)
R = abs(R_y)
orb_name = "py"
R = R**2
X = R * np.sin(THETA) * np.cos(PHI)
Y = R * np.sin(THETA) * np.sin(PHI)
Z = R * np.cos(THETA)
fig = plt.figure()
ax = plt.axes(projection='3d')
ax.plot_surface(X, Y, Z, cmap='cividis')
ax.set_xlim(-R.max(),R.max())
ax.set_ylim(-R.max(),R.max())
ax.set_zlim(-R.max(),R.max())
ax.set_title("$Y^2$"+orb_name)
plt.show()
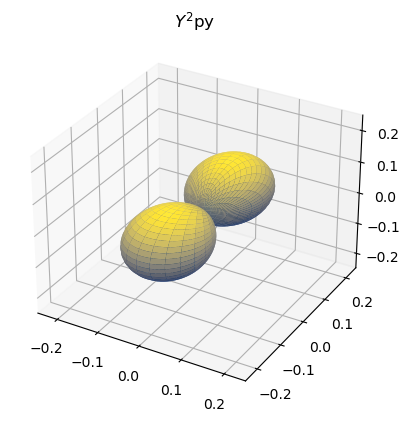
A continuación se dan las expresiones de algunos orbitales
Orbital |
Eigenfunción |
|---|---|
\(1s\) |
\(N_1 e^{-r}\) |
\(2s\) |
\(N_2 (2-r)e^{-r/2}\) |
\(2p_x\) |
\(N_2 r \sin\theta \cos\phi e^{-r/2}\) |
\(2p_y\) |
\(N_2 r \sin\theta \sin\phi e^{-r/2}\) |
\(2p_z\) |
\(N_2 r \cos\theta e^{-r/2}\) |
donde \(N_1\) y \(N_2\) son factores de normalización.
12.1. Referencias#
J. Autschbach, Orbitals: Some Fiction and Some Facts, J. Chem. Educ. 89, 1032 (2012).
P.C. Hiberty, F. Volatron, y S. Shaik, In Defense of the Hybrid Atomic Orbitals, J. Chem. Educ. 89, 575 (2012).
M. Labarca y O. Lombardi, Why orbitals do not exist?, Foundations of Chemistry 12, 149 (2010).
F.W. Eagle, K.D. Seaney, y M.P. Grubb, Musical Example To Visualize Abstract Quantum Mechanical Ideas, J. Chem. Educ. 94, 1989 (2017).
P. W. Atkins, y R. Friedman, Molecular Quantum Mechanics (Oxford University Press, 2005).
F.L. Pilar, Elementary Quantum Chemistry (Dover ed., 2001).
I.N. Levine, D.H. Busch, y H. Shull, Quantum chemistry (Pearson Prentice Hall Upper Saddle River, NJ, 2009).
D.A. McQuarrie y J.D. Simon, Physical Chemistry: A Molecular Approach (University Science Books, 1997).


